Mimotělní oběh
DEFINICE
Mimotělní oběh (MO) je přístroj, jehož základní úlohou je nahradit krevní oběh (perfuzi) a dýchání (oxygenaci) organismu v době srdeční zástavy při chirurgickém výkonu na srdci nebo velkých cévách. K základním funkcím patří i regulace tělesné teploty. Za specifických okolností možno s využitím přídatných zařízení realizovat i další procesy, jako hemokoncentrace nebo hemodialýza.
Úspěšné použití metody mimotělního oběhu je založeno na znalosti a využití fyzikálních principů a současně na porozumění fyziologickým a patofyziologickým dějům v lidském organizmu. Cílem technických řešení je dosažení souladu mezi fyzikálními a chemickými jevy (mechanika, reologie, termika, acidobazická rovnováha apod.), nároky organizmu na zabezpečení fyziologických funkcí (perfuze, výměna plynů), farmakologickými vlivy (heparin, protamin, katecholaminy, vazodilatační farmaka) a biologickou odpovědí organizmu na tuto specifickou zátěžovou situaci (systémová zánětlivá reakce - SIRS).


Principy mimotělního oběhu
PERFUZE
Podmínkou dostatečné perfuze orgánů nemocného během mimotělního oběhu je udržení adekvátního minutového výdeje a perfuzního tlaku. Nároky na velikost minutového výdeje jsou různé v závislosti na velikosti těla nemocného, jeho stáří a aktuální teplotě organizmu a lze je pro konkrétního nemocného stanovit výpočtem:
| |
l . min-1 . m-2 |
| Normotermie |
2,5 - 2,8 |
| Mírná hypotermie |
2,2 - 2,4 |
| Při teplotě pod 28 °C |
1,6 |
| Při teplotě pod 20 °C |
1,2 |

V současné době je ale zároveň doporučeno přizpůsobit průtok během MO celkovému stavu nemocného. Příkladem jsou hypertonici a vyšší Věkové skupiny, u kterých by se velikost výdeje měla pohybovat až kolem 3 l . min-1 . m-2 .
Při nedostatečném průtoku klesá spotřeba kyslíku VO2 a není perfundováno celé kapilární řečiště. I ty oblasti, které jsou otevřené, nejsou perfundovány optimálně (vznik laktátu, metabolická acidóza).
Při vysokém průtoku dochází v systému MO k vyšší traumatizaci krve (vysoké tlakové gradienty, vyšší otáčky čerpadla), k vyšší expozici krve ve styku s umělými povrchy, a k četnějším plynovým embolizacím (kavitace a bublinky v cirkulující krvi).
Doporučená hodnota perfuzního tlaku během MO - při současném dodržení vypočteného potřebného minutového výdeje - se pohybuje mezi 50 - 75 mm Hg. Při vyšším perfuzním tlaku hrozí nebezpečí rozpojení systému MO i krvácivých komplikací u nemocného. U nižšího tlaku byly obavy z poškození CNS, ukázalo se ale, že k tomu při zachovaném dostatečném průtoku nedochází. Výjimku tvoří rizikové skupiny nemocných – pacienti staří, s těžkým aterosklerotickým postižením aorty, s hypertenzí a diabetem.
Tok krve v arteriální lince vytvářený čerpadlem MO je nepulzatilní. Některá technická zařízení umožňují vytvářet pulzatilní tok krve, který má popsaný přínos především na úrovni mikrocirkulace (přídatná energie pro transport erytrocytů v kapilárách), v praxi nebyl ale shledán rozdíl v mortalitě a morbiditě.

VÝMĚNA PLYNŮ
Během srdeční zástavy je přerušena cirkulace v plicním oběhu, a tedy i výměna dýchacích plynů v krvi. Parciální tlaky O2 a CO2 v desaturované žilní krvi musí být před návratem do systémového řečiště nemocného upraveny na hodnoty arteriální krve. Změny pO2 a pCO2 probíhají v oxygenátoru v závislosti na řízeném složení a průtoku směsi plynů (vzduchu a O2). Kyslík difunduje do krevní plazmy přes membránu na základě gradientu mezi vysokým pO2 ve směsi plynů v přístroji a nízkým pO2 v žilní krvi přitékající z nemocného. Na obráceném principu funguje výměna CO2, s tím rozdílem, tento proces je vždy mnohem efektivnější než proces oxygenace z důvodu vysokého stupně difuze CO2 plazmou (přestože tlakový gradient není tak velký).
Při spuštěném mimotělním oběhu musí být trvale monitorována kvalita oxygenace na základě hodnot acidobázické rovnováhy. Hodnota pO2 v tepenné krvi je indikátorem funkce oxygenátoru a hodnota saturace O2 ve smíšené žilní krvi z pacienta je známkou dostatečnosti tkáňového okysličení. Hodnota arteriálního pO2 by se měla pohybovat v rozmezí 85-200 mmHg (11,3 - 26,6 kPa) – pod touto hodnotou je organizmus ohrožen hypoxií, nad touto hodnotou vzniká riziko toxicity kyslíku, tvorby mikrobublin a volných kyslíkových radikálů.
REGULACE TEPLOTY
Během vedení mimotělního oběhu lze změnou teploty přečerpávané krve aktivně ovlivnit teplotu organizmu nemocného. V srdeční chirurgii se tento postup velmi často využívá k cílenému navození hypotermie různého stupně a následně k obnovení normotermie v závěru operace.
Hypotermie zpomaluje buněčný metabolismus a tím i snižuje nároky tkání na perfuzi okysličenou krví. Během ischemické periody jsou dostupné zásoby energie schopné udržet viabilitu buněk, což v další fázi umožní normální strukturální a funkční zotavení po reperfuzi. Použití systémové hypotermie tedy umožňuje snížit průtoky během MO, a tím, kromě jiného, snížit i traumatizaci krevních elementů a zlepšit ochranu myokardu i ostatních orgánů.
 Historicky byla hypotermie základním protektivním opatřením při prvních srdečních operacích. V současnosti již ochranný význam hypotermie není tak dominantní, řada pracovišť provádí kardiochirurgické výkony v normotermii. Stupně hypotermie možno nasledovně rozdělit (dle Wonga):
Historicky byla hypotermie základním protektivním opatřením při prvních srdečních operacích. V současnosti již ochranný význam hypotermie není tak dominantní, řada pracovišť provádí kardiochirurgické výkony v normotermii. Stupně hypotermie možno nasledovně rozdělit (dle Wonga):
| Mírná |
35 °C – 32 °C |
| Střední |
31 °C – 26 °C |
| Hluboká |
25 °C - 20 °C |
| Velice hluboká |
19 °C – 14 °C |
Rutinní kardiochirurgické operace se nejčastěji provádějí v normotermii. Hluboká až velice hluboká hypotermie se cíleně volí u operací, kde provedení chirurgického výkonu vyžaduje nastolení dočasné totální cirkulační zástavy (operace na vzestupné aortě a oblouku aorty, některé operace v dětské kardiochirurgii). Během totální zástavy oběhu je hluboká hypotermie základním ochranným mechanizmem bránícím poškození mozku a dalších orgánů. Délka zástavy nesmí přesáhnout 40-45 minut. V současné době existují i další způsoby ochrany CNS, díky kterým je možné snížit hloubku hypotermie a zároveň prodloužit bezpečnou dobu celkové cirkulační zástavy, jako například antegrádní perfuze mozku (karotickými tepnami), nebo retrográdní perfuze mozku (kanylou zavedenou do horní duté žíly, utěsněnou turniketem). Tímto způsobem možno prodloužit dobu totální zástavy až na 60-80 minut.
Navození hypotermie i obnovení normotermie organizmu je aktivně řízeným procesem. Uskutečňuje se změnou teploty cirkulující krve pomocí výměníku tepla a vodního lůžka pod tělem operovaného. Teplotu organizmu ovlivňuje i místní aplikace ledové tříště v operační ráně, teplota infuzních roztoků a teplota operačního sálu.
Protože se během hypotermického MO mění teplota organismu nerovnoměrně, je třeba sledovat jednak teplotu tělesného jádra (centrální), jednak teplotu periferie. Centrální teplotu monitorujeme v distálním jícnu, nasopharyngu, či v močovém měchýři. Pro měření periferní teploty se nejčastěji využívá rektum. Velmi vhodné je sledovat také teplotu krve v tepenné a žilní lince MO. Za úplně ohřátého možno pacienta považovat při teplotě jádra 37°C a teplotě periferie >35°C.
HEPARIN
Před zavedením kanyl pro mimotělní oběh a jeho zahájením musí být dosaženo adekvátní antikoagulace, aby nedošlo ke vzniku krevních sraženin v přístroji, zejména oxygenátoru, a následně k jeho dysfunkci. K tomuto cíli je využíváno nefrakcionovaného heparinu. Jedná se o směs mukopolysacharidů s molekulovou váhou od 3 000 - 30 000 daltonů, která působí jako kofaktor antitrombinu III (inhibitor FII koagulační kaskády – trombinu), čím dojde ke znemožnění tvorby trombu.

 Úroveň heparinizace je během mimotělního oběhu průběžně sledována obvykle testem ACT - activated clotting time (jedná se o čas do vzniku trombu při kontaktu krve s celitem). Výrobci oxygenátorů většinou požadují jeho hodnotu nad 480 s. K dosažení těchto hodnot se zpravidla musí podat nemocnému heparin v dávce 2-3 mg . kg-1.
Úroveň heparinizace je během mimotělního oběhu průběžně sledována obvykle testem ACT - activated clotting time (jedná se o čas do vzniku trombu při kontaktu krve s celitem). Výrobci oxygenátorů většinou požadují jeho hodnotu nad 480 s. K dosažení těchto hodnot se zpravidla musí podat nemocnému heparin v dávce 2-3 mg . kg-1.
Biologický poločas heparinu je individuální a pohybuje se mezi 1- 2 hodinami. Při normotermii se heparin metabolizuje rychleji. Při déletrvajících operacích je podle výsledku ACT často zapotřebí heparin přidávat.
Po ukončení mimotělního oběhu a odstranění kanyl z velkých cév je antikoagulační účinek heparinu zrušen podáním protaminu. Protamin (nízkomolekulární protein extrahovaný ze spermií lososa) je okamžitý antagonista účinků heparinu, vytváří s ním inertní komplex.
SYSTÉMOVÁ ZÁNĚTLIVÁ ODPOVĚĎ
Zavedení a spuštění mimotělního oběhu je - přes neustálá vývojová zlepšení - pro organizmus nefyziologickou zátěžovou situací. Styk krve s neendotelizovaným povrchem hadic a oxygenátoru MO vede vždy k rozvoji systémové zánětlivé reakce organizmu. Dochází k aktivaci proteinových i buněčných složek krve (komplementový, kalikrein-kininový, koagulační i fibrinolytický systém, aktivace trombocytů, endotelových buněk a leukocytů). Kromě zmíněného mechanizmu se na reakci organizmu podílí i negativní efekt heparinu a protaminu, tkáňová ischemie a reperfuze, hypotermie, relativní hypotenze a nepulzní krevní tok, anémie, podávání transfuzních přípravků. Výsledkem je tzv. SIRS - systemic inflammatory response syndrome. Zánětlivá odpověď u převážné většiny operovaných probíhá bez zjevné klinické symptomatologie, může se však u některých nemocných projevit jako tzv. postperfuzní syndrom.
Mezi projevy postperfuzního syndromu patří respirační selhání (ARDS - adult respiratory distress syndrome), postižení CNS (CMP – cévní mozková příhoda; difuzní postižení mozkové kůry), ledvin (akutní renální selhání), slinivky břišní (akutní pankreatitida), gastrointestinálního traktu (akutní vředová léze), jater (hepatální selhání), poruchy koagulace (DIC - diseminovaná intravaskulární koagulace) či hypertermie. Významné postižení několika orgánových systémů může vést k multiorgánovému poškození (MODS – multiple organ dysfunction syndrome) až selhání (MOF – multiple organ failure).
S cílem zvýšení biokompatibility mimotělního oběhu jsou v současnosti používány různé formy krytí vnitřního povrchu hadic. Mechanizmem je snížení aktivace koagulačního, ale i ostatních krevních humorálních systémů. Nejpopulárnějším krytím je heparin, který má i nejlepší klinické výsledky.
Součásti přístroje pro mimotělní oběh
ŽILNÍ DRENÁŽ
Žilní drenáž je odvod desaturované žilní krve nemocného do přístroje pro mimotělní oběh. Krev je do přístroje sváděna působením gravitace (výškový rozdíl mezi operačním stolem a nízko umístěným žilním rezervoárem), nebo v případě potřeby s použitím aktivního sacího mechanizmu (VAVD, viz níže).
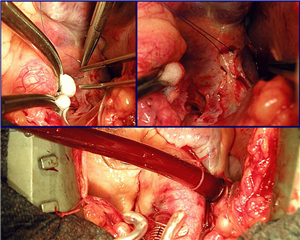
 Technicky se žilní drenáž provádí zavedením žilních kanyl do centrálního žilního řečiště. Kanyly se zavádějí přes pravou síň do horní a dolní duté žíly přes incize opatřené cirkulárními stehy. Takto vytvořená žilní drenáž umožňuje tok krve kolem kanyl do pravé síně (parciální/částečný mimotělní oběh). Toto nastavení neumožňuje bezkrevné operační pole v pravostranných srdečních oddílech. Pokud ale opatříme obě duté žíly turnikety, které zamezí protékání krve kolem kanyl, vznikne nastavení nazývané totální mimotělní oběh -veškerá krev vcházející do srdce je odváděna do MO. Žilní drenáž je možno zajistit i periferní cestou, tj. speciální kanylou do femorální a případně i jugulární žíly.
Technicky se žilní drenáž provádí zavedením žilních kanyl do centrálního žilního řečiště. Kanyly se zavádějí přes pravou síň do horní a dolní duté žíly přes incize opatřené cirkulárními stehy. Takto vytvořená žilní drenáž umožňuje tok krve kolem kanyl do pravé síně (parciální/částečný mimotělní oběh). Toto nastavení neumožňuje bezkrevné operační pole v pravostranných srdečních oddílech. Pokud ale opatříme obě duté žíly turnikety, které zamezí protékání krve kolem kanyl, vznikne nastavení nazývané totální mimotělní oběh -veškerá krev vcházející do srdce je odváděna do MO. Žilní drenáž je možno zajistit i periferní cestou, tj. speciální kanylou do femorální a případně i jugulární žíly.
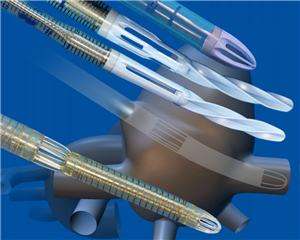 Další možností je použití jedné společné dvoustupňové kanyly (tzv. two-stage venous cannnula), která se zavádí do ouška pravé síně – je opatřená jedním otvorem na konci, který odvádí krev z dolní duté žíly a druhým otvorem proximálněji, odvádějícím krev přitékající do síně z horní duté žily. Tato forma kanylace neumožňuje totální mimotělní oběh.
Další možností je použití jedné společné dvoustupňové kanyly (tzv. two-stage venous cannnula), která se zavádí do ouška pravé síně – je opatřená jedním otvorem na konci, který odvádí krev z dolní duté žíly a druhým otvorem proximálněji, odvádějícím krev přitékající do síně z horní duté žily. Tato forma kanylace neumožňuje totální mimotělní oběh.
Asistovaný žilní návrat
Při standardním uspořádání mimotělního oběhu přitéká žilní krev k žilnímu rezervoáru pasivně působením gravitace. Pro udržení dostatečného přítoku krve je nutné použít poměrně širokou žilní kanylu (kanyly). Často ale dochází k situaci, kdy je žilní návrat nedostatečný. Tuto situaci možno řešit vřazením prvku aktivního sání do žilní části systému.
 Systém VAVD (vacuum assisted venous drainage) pracuje na principu udržování kontrolovaného podtlaku nad hladinou krve v žilním rezervoáru. Speciálně upravený rigidní rezervoár je spojen se zdrojem kontrolovaného podtlaku. Systém je plně uzavřený, klinické výsledky jsou výborné.
Systém VAVD (vacuum assisted venous drainage) pracuje na principu udržování kontrolovaného podtlaku nad hladinou krve v žilním rezervoáru. Speciálně upravený rigidní rezervoár je spojen se zdrojem kontrolovaného podtlaku. Systém je plně uzavřený, klinické výsledky jsou výborné.
REZERVOÁR
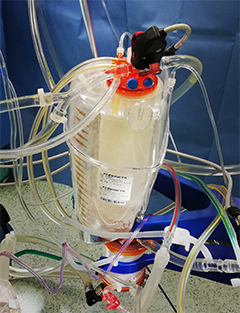 Žilní rezervoár plní funkci zásobárny krve celého systému a je vřazen před arteriální pumpu (představuje „síň“). Slouží ke gravitační drenáži žilní krve z oběhu nemocného a k vyrovnávání výkyvů mezi žilním přítokem a aktuálními potřebami přísunu krve k čerpadlu. V rezervoáru jsou pomocí filtru odstraňovány bubliny a lze do něj aplikovat léky. Používají se 2 typy rezervoáru – plastický a rigidní.
Žilní rezervoár plní funkci zásobárny krve celého systému a je vřazen před arteriální pumpu (představuje „síň“). Slouží ke gravitační drenáži žilní krve z oběhu nemocného a k vyrovnávání výkyvů mezi žilním přítokem a aktuálními potřebami přísunu krve k čerpadlu. V rezervoáru jsou pomocí filtru odstraňovány bubliny a lze do něj aplikovat léky. Používají se 2 typy rezervoáru – plastický a rigidní.
- Plastický žilní rezervoár - používá se v tzv. uzavřeném systému. Po naplnění přístroje pro mimotělní oběh se z rezervoáru odsaje vzduch, rezervoár je naplněn pouze krví. V případě vyčerpání veškeré krve z rezervoáru se odtok z něj zablokuje kolapsem plastické stěny (zábrana nasátí vzduchu). Součástí systému musí být krom něho ještě další, tzv. kardiotomický rezervoár, shromažďující krev odsátou z operačního pole a srdečních dutin.
- Rigidní rezervoár - používá se pro tzv. otevřený systém. Má komunikaci s okolním atmosférickým tlakem (pokud není nutnost použití VAVD). Jeho součástí je kardiotomický rezervoár, který je od žilní části alespoň částečně oddělen. Rizikem otevřeného systému je vzduchová embolizace v případě vyčerpání rezervoáru. Proto musí být po celou dobu dodržována minimální pracovní náplň.
- Kardiotomický rezervoár - je sběrné zařízení pro krev odsátou z operačního pole a tzv. venty (sacími kanylami zavedenými do některých srdečních dutin k odsávání nadměrné krevní náplně). Krev z kardiotomického rezervoáru prochází před návratem do žilního rezervoáru filtrací. Ta je nutná z důvodu přítomnosti částeček tkání, tuku, kostí, šicího materiálu, kalcia, fibrinu, krevních koagul, mikroagregátů nebo bublin v odsávané krvi.
ČERPADLO
Čerpadlo (pumpa) je základním prvkem přístroje pro mimotělní oběh. Nahrazuje srdce v krevním oběhu - pročerpává desaturovanou krev z venózní části přístroje pro MO do oxygenátoru a arteriální části. Požadavkem je dostatečný čerpací výkon (zajištění vypočteného minutového výdeje), technicky spolehlivý provoz a šetrnost vůči krevním elementům. V současnosti jsou v klinické praxi používány 2 typy čerpadel:
 Válečková pumpa
Válečková pumpa
Nejstarší a nejrozšířenější čerpadlo. Principem je posouvání krve v elastické hadici 2 rotujícími válečky postavenými vzájemně v opačné poloze (180°), které stlačují průsvit trubice. Velikost průtoku krve je dána šířkou a délkou hadice vložené do statoru a počtem otáček motoru. Důležité je správné nastavení přítlačné síly válečků na hadice (tzv. okluze) tak, aby byl zachován dostatečný průtok krve pumpou, a současně nedocházelo k nadměrné mechanické destrukci krevních elementů.
 Centrifugální pumpa
Centrifugální pumpa
Principem je postupné zrychlování krve přitékající do pumpy pomocí rotujícího hladkého kužele nebo rotujících lopatek. V okamžiku dosažení největší rychlosti na obvodu kužele je krev odstředivou silou odvedena do odvodné hadice. V případě technické překážky v odtoku či přítoku nehrozí havárie - čerpadlo není schopno kriticky zvyšovat přetlak či podtlak. Provoz je spolehlivý a šetrný, s minimálním rizikem embolizace mikrobublin. Je prokázána nižší úroveň hemolýzy, aktivace krevních elementů i humorálních systému v krvi. Nevýhodou je vyšší cena zařízení na jedno použití.
OXYGENÁTOR
 Základní součást přístroje pro mimotělní oběh, ve kterém plní funkci „plic“. Slouží k regulované výměně plynů mezi krví nemocného a přiváděnou směsí plynů. Funkční kapacita oxygenátoru je úměrná velikosti povrchu, na kterém dochází k výměně plynů po koncentračním spádu.
Základní součást přístroje pro mimotělní oběh, ve kterém plní funkci „plic“. Slouží k regulované výměně plynů mezi krví nemocného a přiváděnou směsí plynů. Funkční kapacita oxygenátoru je úměrná velikosti povrchu, na kterém dochází k výměně plynů po koncentračním spádu.
Konstrukční typy :
- bublinkový - k výměně plynů docházelo během přímého kontaktu krve s O2 (probublávání). Dnes se již nepoužívá (mikroembolizace, traumatizace krevních elementů, zánětlivá odpověď).
- membránový - krev a směs plynů je oddělena membránou o velkém povrchu (2 - 5 m2). Jsou do okruhu vřazeny až za čerpadlo, protože jejich větší rezistence vyžaduje, aby jimi byla krev transportována pod určitým tlakem. Existují 2 základní varianty:
- "Pravý" membránový oxygenátor - membrána je tvořena silikonem, který není porézní, plyny prostupují pouze difuzí. Výhodou je dlouhodobá dobrá funkce, nevýhodou velký plnicí objem, velký cizí povrch a vysoká cena. Oxygenátor je vhodný pro dlouhodobou umělou oxygenaci nemocného (ECMO).

- Oxygenátor z dutých vláken - vlákna jsou z mikroporézního polypropylénu (velikost pórů menší než 1 µm). Vlákna vytvářejí jakousi kapilární „síť“ napodobující plicní řečiště. Velikost pórů nedovoluje prostup ani plynů ani plazmy a krevních elementů. Jsou používány v rutinním kardiochirurgickém provozu. Nevýhodou je snižování funkční kapacity po několika hodinách. Vlákna jsou uspořádána do prostorové sítě, intraluminálně proudí plyn a extraluminálně jsou obtékána krví. Množství CO2 i O2 v krvi možno regulovat nastavením rychlosti průtoku plynu přístrojem, resp. změnou frakce O2 ve směsi vstupujících plynů. Účinnost oxygenátoru je závislá na rychlosti průtoku krve oxygenátorem, její viskozitě, zevním průměru dutého vlákna, na velikosti mrtvého prostoru mezi vlákny a celé řadě dalších konstrukčních faktorů.
VÝMĚNÍK TEPLA

 Výměník tepla zabezpečuje ochlazování a ohřívání cirkulující krve v přístroji pro mimotělní oběh. Je součástí každého oxygenátoru a je umístěn v jeho žilní sekci před okysličovací jednotkou. Na jedné straně jeho povrchu je krev a na straně druhé cirkulující voda. Kompartmenty jsou odděleny tepelně vodivým materiálem (anodizovaný hliník, nerezová ocel nebo plasty).
Výměník tepla zabezpečuje ochlazování a ohřívání cirkulující krve v přístroji pro mimotělní oběh. Je součástí každého oxygenátoru a je umístěn v jeho žilní sekci před okysličovací jednotkou. Na jedné straně jeho povrchu je krev a na straně druhé cirkulující voda. Kompartmenty jsou odděleny tepelně vodivým materiálem (anodizovaný hliník, nerezová ocel nebo plasty).
Pro fungování výměníku je nezbytná externí tepelná jednotka („heater – cooler unit“), která je zdrojem vody o přesně zvolené teplotě. Ta je vedena hadicemi do výměníku tepla. Zde protéká systémem spirál či tenkých trubic, přes jejichž stěnu dochází ke změně teploty cirkulující krve.
 ARTERIÁLNÍ KANYLA
ARTERIÁLNÍ KANYLA
Arteriální kanyla slouží k návratu okysličené krve z přístroje pro mimotělní oběh zpět do arteriálního krevního řečiště nemocného. Musí splňovat náročné konstrukční požadavky vzhledem ke svému umístění ve vysokotlaké části mimotělního oběhu a napojení do tepenného řečiště nemocného.
Nejčastějším místem zavedení arteriální kanyly je distální část vzestupné aorty před odstupem truncus brachiocephalicus. Za speciálních okolností je možné tuto kanylu zavést cestou stehenní nebo axilární tepny. Kanyly pro tyto postupy jsou speciálně upravené.
PŘÍDATNÁ ZAŘÍZENÍ
- Vent
Jedná se o sací kanylu, která se zavádí do některého srdečního oddílu v průběhu trvání mimotělního oběhu. Cílem je zabránit nadměrné distenzi zejména levé komory, zabezpečit bezkrevnost a přehlednost operačního pole a usnadnit odvzdušnění srdečních dutin v závěru operace.
- Koronární sání
Přídatné sání, které umožňuje chirurgovi odsávat krev z operačního pole přímo do přístroje pro mimotělní oběh – do kardiotomického rezervoáru. Představuje největší zdroj hemolýzy, korpuskulárních i plynových embolizací do MO.
- Filtry
Nejdůležitějším zástupcem je arteriální filtr, který je vřazen do arteriální linky za oxygenátor. Konstrukčně se jedná o síť polyesterových vláken o průměru pórů 20 - 40 µm. Je schopen eliminovat jednak korpuskulární mikroemboly a také emboly plynného charakteru (tzv. vychytávač bublin – „bubbletrap“). Za jejich nejzávažnější zdroj se považuje koronární sání.
- Hemokoncentrátor
Zařízení určené k okamžitému odstranění přebytečného množství krystaloidů z perfuzátu, a tím ke zvýšení hematokritu cirkulující krve. Probíhá v něm oddělení buněčných a bílkovinných složek krve od vody a nízkomolekulárních látek v plazmě na principu ultrafiltrace přes semipermeabilní membránu. Indikací k jeho použití je pokles hematokritu během mimotělního oběhu pod 0,20, předoperační hyperhydratace v důsledku srdečního selhávání, dlouhotrvající mimotělní oběh a známé snížení ledvinných funkcí. Zapojuje se obvykle za arteriální filtr a je spojen i s kardiotomickým rezervoárem (možnost recirkulace).
Vedení mimotělního oběhu
PŘÍPRAVA PERFUZIONISTY
Perfuzionista - osoba, která mimotělní oběh vede - se seznámí s typem operace a dokumentací nemocného. Na základě toho zvolí vhodný typ systému a kanyl. Dále provede výpočty povrchu nemocného, požadovaného systémového průtoku během MO a objemu náplně celého systému, aby nedošlo k nadměrné hemodiluci. O celé perfuzi vede záznam. Celý systém naplní náhradními roztoky a odvzdušní. Takto je daný systém připravený ke spojení s cévním systémem nemocného. Po přípravě systému perfuzionista ještě znovu celý postup zkontroluje podle formuláře a manuálu kontrolních postupů.
PŘÍPRAVA NEMOCNÉHO
Po provedení sternotomie je nemocnému podán heparin. Chirurg vypreparuje cílové struktury pro zavedení kanyl (nejčastěji vzestupná aorta a ouško pravé síně). V místech předpokládaných incizí založí cirkulární stehy s turnikety. Jakmile je dosaženo účinné heparinizace (dle ACT), chirurg bodovou incizí v aortě zavede aortální kanylu. Bez přítomnosti vzduchu ji spojí s tepennou linkou MO. Obdobně postupuje i při zavádění žilní kanyly do pravé síně. Následně je vše připraveno k zahájení MO.
ZAHÁJENÍ A VEDENÍ MIMOTĚLNÍHO OBĚHU
MO se zahajuje na pokyn operujícího chirurga. Důležitá je jasná komunikace mezi chirurgem a perfuzionistou. Perfuzionista po uvolnění arteriální linky pomalu zvyšuje otáčky čerpadla, zároveň pomalu uvolňuje průtok žilní linkou tak, aby krev z nemocného začala proudit do systému MO. Otáčky čerpadla jsou zvyšovány, aby jeho výkon postupně dosáhl potřebné vypočítané hodnoty. Perfuzionista otevře průtok plynů do oxygenátoru a případně začne nemocného ochlazovat na plánovanou teplotu. Následně je možno přistoupit k vlastnímu chirurgickému výkonu na odlehčeném / zastaveném srdci.
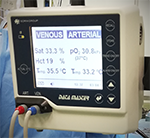
Během MO je sledován průtok krve čerpadlem, tlak v systému MO, tlak nemocného, teplota nemocného v jícnu a v rektu (případně močovém měchýři), teplota tepenné krve, teplota žilní krve, teplota vody, saturace O2 v žilní lince, pO2. V pravidelných intervalech musí být také kontrolována úroveň heparinizace.
UKONČENÍ MIMOTĚLNÍHO OBĚHU
S určitým předstihem před předpokládaným ukončením vlastního výkonu na srdci vydá chirurg perfuzionistovi pokyn, aby začal nemocného opět ohřívat. MO může být ukončen, až když má podchlazený nemocný opět normální teplotu. Po obnovení srdeční činnosti a po fázi odlehčeného oběhu (fáze reperfuze myokardu) lze uvažovat o ukončení MO. Perfuzionista postupně pomalu snižuje návrat žilní krve z nemocného, až je žilní linka úplně uzavřena. Zároveň zpomaluje otáčky čerpadla tak, aby do tepenného řečiště postupně vrátil většinu krve ze systému MO. Sleduje při tom arteriální tlak a náplň srdce. Když se tlak normalizuje a srdce je optimálně naplněné, je možné MO úplně zastavit.
Po skončení výkonu se celý objem systému postupně reinfunduje zpět do cévního řečiště nemocného a po odstranění kanyl se účinek heparinu zruší intravenózním podáním protaminu.
Ochrana myokardu
DEFINICE
Většina kardiochirurgických výkonů v mimotělním oběhu je proveditelná pouze během dočasného vyřazení srdce ze systémové cirkulace. Po zavedení parciálního nebo totálního mimotělního oběhu začíná tato fáze naložením cévní svorky na vzestupnou aortu (klampáž aorty, aortic cross-clamp). Tím je zcela přerušen přítok okysličené krve do koronárního řečiště a pro srdeční svalovinu nastává období globální myokardiální ischemie.
Při normotermické ischemii kardiomyocytů nastává řada patofyziologických dějů - od reverzibilní systolicko-diastolické dysfunkce (myokardiální stunning) až po nekrózu myocytů (za 20 min až několik hodin). Riziko fatálního perioperačního infarktu vedlo k vývoji řady postupů s cílem zachovat viabilitu myokardu během jeho globální ischemie a následně plně obnovit jeho funkčnost v rámci reperfuze.
Společným principem většiny těchto postupů je snaha o minimalizaci metabolických nároků myokardu v období ischemie. Snížení metabolických potřeb myocytů umožní srdci přečkat fázi globální myokardiální ischemie bez klinicky závažného poškození.
 HYPOTERMIE
HYPOTERMIE
Hypotermie snižuje energetické nároky myocytů a tím usnadňuje myokardu tolerovat období globální myokardiální ischemie, sama o sobě však není dostatečnou ochranou srdeční svaloviny po dobu běžně potřebnou k provedení kardiochirurgického výkonu. Protektivní účinek hypotermie se využívá v kombinaci se zástavou srdeční aktivity kardioplegickým roztokem. Ochlazení srdeční svaloviny (zpravidla na 8 - 10 °C) je dosaženo působením 3 faktorů:
- celotělové mírné hypotermie
- místním chlazením srdce ledovou tříští
- perfuzí koronárního řečiště kardioplegickým roztokem o teplotě 4 °C.
Průběžnému ohřívání srdce (od tělesného jádra a nekoronárním průtokem) bráníme opakovaným poléváním ledovou tříští a opakovaným podáváním studeného kardioplegického roztoku.
KARDIOPLEGIE
Nejvýhodnější pro ochranu myokardiálních buněk a zachování jejich nitrobuněčných energetických zdrojů je okamžité zastavení elektromechanické aktivity myokardu ihned po přerušení koronárního průtoku po naložení příčné svorky na aortu. To lze docílit podáním kardioplegického roztoku do koronárního řečiště. Podstatou účinku je navození asystolie v diastole nejčastěji vlivem vysoké koncentrace kalia v podaném roztoku (15-30 mmol/l).
Hyperkalemická zástava srdeční činnosti v diastole funguje na principu změny klidového membránového potenciálu kardiomyocytů z původních -85 mV na přibližně -60 mV. Důvodem je snížení transmembránového gradientu koncentrace kaliových iontů. Nad touto hodnotou již rychlé sodíkové kanály, potřebné pro spuštění akčního potenciálu (a tedy šíření vzruchu myokardem a kontrakci myocytů), není možné aktivovat. Kromě toho se na srdeční zástavě podílí i změny koncentrací dalších iontů v různém rozsahu v závislosti od výběru typu roztoku.

Dle složení iontů rozlišujeme intracelulární roztoky, které mají nízkou koncentraci sodíku a vápníku, a extracelulární roztoky s vysokou hladinou těchto iontů, přibližující se koncentraci v krvi.
| Typ roztoku |
Na+ |
K+ |
Mg2+ |
Ca2+ |
pH |
| St Thomas II (extracelulární) |
120 |
16 |
16 |
1.2 |
7.8 |
| Custodiol (intracelulární) |
15 |
9 |
4 |
0.015 |
7.2 |
| Krevní kardioplegie 4:1 (začátek) |
140 |
20 |
13 |
- |
7.2 |
| Krevní kardioplegie 4:1 (udržování) |
140 |
10 |
9 |
- |
7.4 |
Kardioplegie může být buď krystalická (vždy studená) - podání vodného roztoku iontů, nebo krevní (koncentrovaný kardioplegický roztok doplněný 4 díly oxygenované krve). Krevní kardioplegie představuje lepší ochranu ischemického myokardu (dodávka kyslíku erytrocyty, pufrovací schopnosti krve, onkotická aktivita plazmatických bílkovin). Podle teploty krevní kardioplegie rozlišujeme studenou (4 - 10 °C), teplou (normotermní) a vlažnou (35 °C).
 Kardioplegický roztok se podává antegrádně (do kořene aorty, cíleně do koronárních ústí, do našitých žilních štěpů) nebo retrográdně cestou koronárního sinu (lepší distribuce v případě významné difuzní koronární aterosklerózy) nebo kombinovaně oběma přístupy. Podání roztoku je nutné každých 20-40 minut opakovat, s výjimkou speciálně upravených roztoků, kde postačuje jednorázová úvodní dávka pokrývající delší časové období (90 – 120 minut) – Del Nido, Custodiol atd.
Kardioplegický roztok se podává antegrádně (do kořene aorty, cíleně do koronárních ústí, do našitých žilních štěpů) nebo retrográdně cestou koronárního sinu (lepší distribuce v případě významné difuzní koronární aterosklerózy) nebo kombinovaně oběma přístupy. Podání roztoku je nutné každých 20-40 minut opakovat, s výjimkou speciálně upravených roztoků, kde postačuje jednorázová úvodní dávka pokrývající delší časové období (90 – 120 minut) – Del Nido, Custodiol atd.
BETAPLEGIE
Podobný stav jako u kardioplegické zástavy lze navodit farmakologicky podáním krátkodobě působícího betablokátoru esmololu do vzestupné aorty. Inaktivní myokard je perfundován normotermní krví po celou dobu srdeční zástavy.
OSTATNÍ TECHNIKY
V souvislosti se zvyklostmi pracoviště jsou používány některé další postupy ochrany myokardu při navození globální myokardiální ischemie.
Intermitentní klampáž aorty
Používá se při výkonech na věnčitých tepnách. V mimotělním oběhu v mírné hypotermii (33 °C) chirurg navodí fibrilátorem fibrilaci komor a potom naloží příčnou svorku na aortu. Během našívání periferní koronární anastomózy srdce fibriluje. Po dokončení anastomózy chirurg povolí svorku na aortě a srdce defibriluje – následně v období reperfuze našije proximální anastomózu na vzestupnou aortu a celý postup se může opakovat. Přestože fibrilace komor je energeticky nevýhodná i za hypotermie, klinické zkušenosti s tímto postupem jsou dobré.
Celková zástava oběhu v hluboké hypotermii
Po zavedení mimotělního oběhu se postupně teplota nemocného sníží až na 15 - 20 °C. Současně se nemocný ochlazuje zevním obložením těla vaky s ledovou tříští. Vlastní srdeční výkon se provádí v celkové zástavě oběhu, předpokládaná bezpečná doba je 45 min. Technika se používá v dětské kardiochirurgii.
Zdroje:
- Lonský V. Mimotělní oběh v klinické praxi. Praha: Grada Publishing, 2004. ISBN 80-247-0653-9.
- Wagner R. Kardioanestezie a perioperační péče v kardiochirurgii. Praha: Grada Publishing, 2009. ISBN 978-80-247-1920-7.
- Scarola C. Cardiopulmonary Bypass and Biocompatibility: A Review. Journal of Biomaterials Applications Reviews. p 42-58. Vol 4. 2010
- Angelo FM. "Dr. John H. Gibbon, Jr. and Jefferson's Heart-Lung Machine: Commemoration of the World's First Successful Bypass Surgery". Posters: Jefferson History. 2015. http://jdc.jefferson.edu/jeffhistoryposters/1
- Habertheuer A, Kocher A, Laufer G, Andreas M, Szeto WY, Petzelbauer P, et al. Cardioprotection: a review of current practice in global ischemia and future translational perspective. BioMed research international. 2014;2014:325725.
- Dominik J. Kardiochirurgie. Praha: Grada Publishing, 1998. ISBN: 80-7169-669-2.
- Dominik J.: Kardiochirurgie. In.: Pafko P. et al.: Základy speciální chirurgie, Galén, 2008, s.173-195. ISBN 978-80-7262-402-7
Za kontrolu, praktický náhled k textu a doplnění fotodokumentace děkujeme Martinovi Voltovi, vedoucímu perfuziologovi Kardiochirurgické kliniky Fakultní nemocnice Hradec Králové.
